В живых клетках флуоресцентные белки обычно используются для наблюдения местоположения и динамики белков, органелл и других клеточных компартментов. Было разработано много различных методик для гибридизации флуоресцентных белков и усиления их экспрессии в клетках млекопитающих и других системах. Основным средством доставки химерных генетических последовательностей флуоресцентных белков в клетки являются бактериальные плазмиды и вирусные векторы, полученные методами генной инженерии.
Гены флуоресцентных белков могут быть введены в клетки млекопитающих и другие клетки с помощью соответствующих временных или стабильных векторов (обычно это плазмиды или вирусы). В экспериментах по временной экспрессии генов (часто называемых врeменной трансфекцией) ДНК плазмид или вирусов, введённых в организм-хозяин, не обязательно сливаются с хромосомами, но могут экспрессироваться в цитоплазме в течении короткого периода времени. Экспрессия слитых (гибридных) генов, легко отслеживаемая по флуоресцентному свечению с помощью фильтрационных блоков, соответствующих данному флуоресцентному белку, начинается в течении нескольких часов после трансфекции и продолжается от 72 до 96 часов после введения ДНК плазмид в клетки млекопитающих. Во многих случаях ДНК плазмид могут быть введены в геном устойчивым образом, что порождает стабильные трансформированные клеточные линии. Выбор между временной и стабильной трансфекцией зависит от объектов-мишеней в данном эксперименте.
Для подробного ознакомления с медицинской и исследовательской техникой основных мировых производителей оптических систем и сопутствующего оборудования посетите наш каталог или свяжитесь с нашими специалистами и получите полную профессиональную консультацию по любым, имеющимся у Вас, вопросам.
Базовая конфигурация плазмидного вектора, способного обеспечить перенос генов флуоресцентного белка, имеет несколько необходимых компонентов. Плазмиды должны содержать нуклеотидные последовательности прокариотной клетки, кодирующие начало репликации ДНК в бактерии, и ген устойчивости к антибиотику. Эти элементы, часто называемые челночными последовательностями, обеспечивают размножение и отбор плазмид в бактерии-хозяине для производства необходимого количества векторов для трансфекции в клетки млекопитающих. В дополнение, плазмиды должны содержать один или несколько эукариотических генетических элементов для управления началом транскрипции информационной РНК, сигнал полиаденилирования в клетках млекопитающих, интрон (необязательно) и ген для ко-селекции в клетках млекопитающих. Транскрипционные элементы необходимы для экспрессии представляющего интерес гибридного белка в клетке-хозяине млекопитающего, а селективным геном обычно является антибиотик, обеспечивающий устойчивость содержащих плазмиды клеток. Эти общие условия могут меняться в зависимости от назначения плазмид, и многие векторы имеют широкий спектр дополнительных компонентов, необходимых для конкретных приложений.
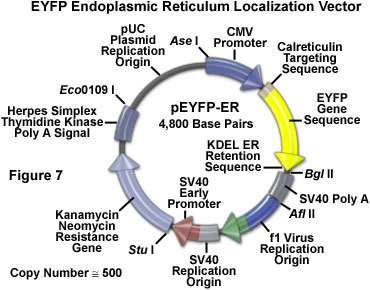
Рис. 7. Рестрикционный фермент и генетическая карта деривата бактериальной плазмиды, содержащей кодирующую последовательность усиленного жёлтого флуоресцентного белка, слитого с последовательностью выступающего в качестве мишени калретикулина (резидентного белка) эндоплазматической сети
На рисунке 7 представлен рестрикционный фермент и генетическая карта серийно выпускаемого (БД Биосайенсис Клонтек) деривата бактериальной плазмиды, содержащей кодирующую последовательность усиленного жёлтого флуоресцентного белка, слитого с последовательностью выступающего в качестве мишени калретикулина (резидентного белка) эндоплазматической сети. В результате экспрессии этого генного продукта в восприимчивых клетках млекопитающих возникает содержащий EYFP химерный пептид, локализованный в мембране эндоплазматической сети и специально разработанный для флуоресцентного окрашивания этой органеллы. Вектор-хозяин является дериватом высококопийной плазмиды pUC (приблизительно 500 копий), содержащей бактериальный репликатор, обеспечивающий размножение специальных штаммов E. сoli. Ген антибиотика канамицина, экспрессированный в бактерии, сообщает ей устойчивость в качестве селективного маркера.
Вектор EYFP, представленный выше, дополнительно содержит промотор цитомегаловируса (CMV) человека для обеспечения экспрессии генов в линии трансфектированных клеток человека и млекопитающих, а также репликатор бактериофага f1 для производства однонитевых ДНК. Векторный остов также включает в себя репликатор обезьяньего вируса (ОВ-40), активного в клетках млекопитающих, которые экспрессируют Т-антиген вируса ОВ-40. Селекция устойчивых к антибиотику G418 трансфектантов обеспечивается кассетой, кодирующей резистентность к неомицину и состоящей из раннего промотора ОВ-40, гена устойчивости к неомицину (аминогликозид 3'-фосфотрансферазы) и сигналов полиаденилирования для вируса простого герпеса тимидинкиназы (ТК ВПГ) для стабильности мРНК. Для большей степени универсальности плазмиды в её остове (см. рисунок 7) присутствуют шесть уникальных рестрикционных ферментов.
Размножение, выделение и трансфекция плазмид флуоресцентных белков
Успешная трансфекция в клетках млекопитающих зависит от того, насколько чистыми и свободными от бактериальных эндотоксинов будут применяемые в эксперименте плазмидные или вирусные векторы. В нативном состоянии молекула кольцевой плазмидной ДНК представляет собой третичную сверхспиральную структуру, в которой двойная спираль закручена вокруг себя несколько раз. В течение лет методом очистки сверхспиральных плазмидных и вирусных ДНК было центрифугирование в градиенте плотности хлористого цезия в присутствии интеркалирующего агента (например, бромистого этидия или йодида пропидия). Этим методом, затратным с точки зрения как оборудования, так и материалов, сверхспиральная (плазмидная) ДНК разделяется на линейную хромосомную и разорванную кольцевую ДНК в соответствии с плавучей плотностью, позволяя собирать плазмидные ДНК высокой степени очистки. Недавно, этот громоздкая и долгая процедура центрифугирования была заменена упрощённым методом ионообменной хроматографии (обычно называемым mini-prep), позволяющим получать свободные от эндотоксинов плазмидные ДНК относительно быстро и в больших количествах.
Специальные бактериальные мутанты, называемые компетентными клетками, были разработаны для удобного и относительно недорогого умножения плазмидных векторов. Благодаря набору специальных мутаций эти бактерии особенно восприимчивы к репликации плазмид, а химически нарушенная проницаемость их мембраны обеспечивает перенос (называемый трансформацией) ДНК через саму мембрану и клеточную оболочку. После трансформации бактерии выращиваются до логарифмической фазы в присутствии антибиотика, с помощью которого осуществляется отбор, управляемый плазмидами с кодом этого антибиотика. Бактериальная культура уплотняется центрифугированием и лизируется раствором щелочного моющего средства, содержащего ферменты для очистки от РНК. После этого лизат фильтруется и помещается на ионообменную колонку. Нежелательные компоненты, включая РНК, ДНК и белки, тщательно вымываются из колонки перед тем, как ДНК плазмид извлекаются с помощью высокосолевого буфера. После этого извлечённые ДНК плазмид осаждаются в спиртовом растворе (изопропаноле), собираются центрифугированием, промываются и опять растворяются в буфере. Очищенные таким образом ДНК готовы для экспериментов по трансфекции.
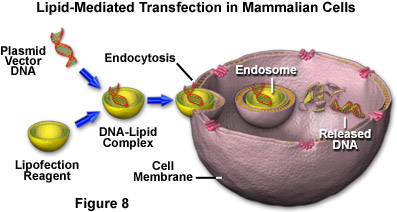
Рис. 8. Липидная трансфекция в клетки млекопитающих
Клетки млекопитающих, используемые для трансфекции, должны быть в превосходном физиологическом состоянии и находиться в логарифмической фазе роста. Для оптимизации внедрения плазмидных ДНК в культивируемые клетки были разработаны многочисленные трансфекционные реагенты, выпускаемые сегодня серийно. Методики внедрения разнообразны: от простого осаждения фосфатом кальция до связывания плазмидных ДНК липосомами, которые проникая сквозь клеточную мембрану, доставляют содержимое в цитоплазму (как показано на рисунке 8). Обобщённо называемые липофекцией, методы с использованием липидов получили широкое распространение благодаря своей эффективности для большого количества популярных клеточных линий и применяются сегодня в большинстве экспериментов по трансфекции.
При врeменной трансфекции потеря плазмидного гена происходит обычно в течение относительно короткого периода (несколько дней), в то время как стабильные линии трансфектированных клеток вырабатывают «гостевые» белки достаточно долго (от нескольких месяцев до нескольких лет). Стабильные клеточные линии могут отбираться с помощью антибиотических маркеров в плазмидном остове (см. рисунок7). Одним из наиболее распространённых антибиотиков для селекции стабильных трансфектантов в линиях клеток млекопитающих является лекарственный препарат G418, подавляющий синтез белков, не его доза значительно меняется в зависимости от клеточной линии. Для селекции стабильных клеток были разработаны и другие часто применяемые антибиотики, включая гидромицин B и пуромицин, которые тоже имеют генетические маркеры. Эффективность получения стабильных клеточных линий определяется эффективностью начальной трансфекции. Электропорация, в этом отношении, оказалась надёжным способом получения стабильных трансфектантов линеаризованными плазмидами и очищенными генами. Метод электропорации заключается в пропускании коротких импульсов высокого напряжения через клеточную суспензию, в результате чего в плазматических мембранах образуются поры, через которые трансфекционные ДНК попадают в клетки. Процедура электропорации требует специального оборудования, тем не менее, его стоимость сравнима с затратами на липофекционные реагенты при выполнении большого числа трансфекций.
Будущее флуоресцентных белков
Современное развитие флуоресцентных белков идёт по двум основным направлениям. Первое — окончательная «доводка» существующей палитры (от синих до жёлтых) флуоресцентных белков, полученных из медузы Aequorea victoria, а второе — усовершенствование мономерных флуоресцентных белков, испускающих в видимом диапазоне от оранжевого до дальнего красного. Прогресс, достигнутый в этих направлениях, действительно впечатляет, и появление на горизонте ближних инфракрасных флуоресцентных белков уже не кажется невообразимым.
Последнее поколение белков, выделенных из медузы, во многом восполнило дефицит первых флуоресцентных белков, особенно жёлтых и зелёных дериватов. Поиск мономерного, яркого и быстро созревающего красного флуоресцентного белка привёл к нескольким новым и интересным классам флуоресцентных белков, особенно тех, которые были выделены из кораллов. Дальнейшее расширение цветовой палитры происходит как за счёт развития существующих флуоресцентных белков, так и благодаря новым технологиям, например, внедрению искусственных аминокислот. А поскольку оптические методы спектрального разделения продолжают развиваться и становятся более распространёнными, эти новые варианты обязательно дополнят существующую палитру, особенно в жёлтом и красном участках спектра.
Сегодня в технологии флуоресцентных зондов имеет место тенденция к повышению роли красителей, флуоресцирующих в дальнем красном и ближнем инфракрасном. В клетках млекопитающих и автофлуоресценция, и поглощение света резко сокращаются на красном конце спектра. Таким образом, развитие дальних красных флуоресцентных красителей будет чрезвычайно полезным для исследования толстых образцов и животных целиком. В случае успешного использования флуоресцентных белков в качестве репортерных молекул в трансгенных системах, применение красных флуоресцентных белков в целых организмах станет в ближайшие годы чрезвычайно важным.
Наконец, только сейчас начинает осознваться огромный потенциал приложения флуоресцентных белков для создания биосенсоров. Количество различных биосенсоров стремительно растёт. Использование структурной информации приводит к постоянному повышению их чувствительности. Успехи в этом направлении вселяют уверенность в том, что почти любой биологический параметр можно будет измерить биосенсором на базе соответствующего флуоресцентного белка.