Мощность лазеров
С увеличением мощности лазерного излучения, интенсивность флуоресценции растет до точки насыщения флуорофоров. Условие насыщения возникает, когда мощности лазера достаточно для перевода значительной доли флуоресцентных молекул из основного в возбужденное состояние (для однофотонного возбуждения она составляет примерно 1 милливатт, а для двухфотонного возбуждения — 50 милливатт). При больших уровнях мощности избыточные фотоны просто неспособны возбуждать флуоресцентные молекулы. Любое облучение за точкой насыщения приводит только к фотоповреждению и фотообесцвечиванию. Поэтому, каждую экспериментальную установку необходимо оценивать с точки зрения повреждений, вызываемых сканированием луча; кроме того, также важно осознавать, что обычные тесты на жизнеспособность клетки (такие как активность эстеразы или освобождение красителя) не всегда точно отражают фотоповреждение клетки. Во многих экспериментах более строгие функциональные пробы могут оказаться более информативными. Например, в одном недавно опубликованном исследовании, жизнеспособность эмбриона хомяка была подтверждена его продолжающимся развитием, а в другом, жизнеспособность панкреатических островков — поддержанием нормальной NAD(P)H реакции.
Для подробного ознакомления с флуоресцентными микроскопами основных мировых производителей оптических систем и сопутствующего оборудования посетите наш каталог или свяжитесь с нашими специалистами и получите полную профессиональную консультацию по любым, имеющимся у Вас, вопросам.
Примеры применения микроскопии с двухфотонным возбуждением
В недавно опубликованных результатах целого ряда экспериментов приведены общие примеры, когда двухфотонное возбуждение имеет преимущество над конфокальным методом. Не обсуждая эти эксперименты в подробностях, можно утверждать, что главное место в них отводится преимуществам двухфотонного возбуждения, связанным с меньшей фототоксичностью, увеличенной глубиной наблюдения тканей и возможностью инициировать локализованную фотохимию.
Микроскопия с двухфотонным возбуждением, в общем, менее токсична по сравнению с конфокальной микроскопией, как было показано в недавнем исследовании, где применялась съемка развития эмбриона хомяка в заданный временной интервал. В этом примере развитие эмбриона можно было непрерывно наблюдать более 10 часов с помощью двухфотонного возбуждения прижизненного митохондриального красителя. Для сравнения, при наблюдении конфокальным способом нормальное развитие эмбриона прекращалось уже через несколько минут после облучения конфокальным лазером. Исследователи заключили, что необычайно возросшая жизнеспособность эмбриона стала возможной благодаря большей длине волны (1047 нанометров) лазера с двухфотонным возбуждением. Эти же исследователи использовали микроскопию с двухфотонным возбуждением для оценки влияния на развитие эмбриона хомяка минерального фосфата. В этом эксперименте живые эмбрионы хомяка выращивались в различных количествах минерального фосфата, а их митохондриальное распределение наблюдалось в возрасте 6 часов с помощью микроскопии с двухфотонным возбуждением. В процессе наблюдения дальнейшего развития эмбриона в возрасте 27 и 51 часа был выполнен морфологический анализ. Из этого исследования были получены ясные доказательства того, что двухфотонное освещение не нарушает развития эмбрионов хомяка; в то же время как при проведении параллельного конфокального наблюдения, они были повреждены.
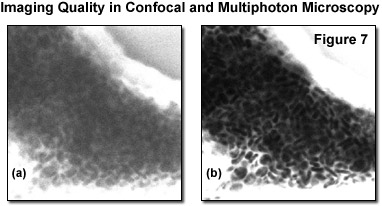
Рис. 7. Качество изображения в конфокальной и многофотонной микроскопии
Два опубликованных исследования были посвящены нетоксичному характеру двухфотонного возбуждения при визуализации in vivo человеческой кожи. Одно исследование включало детальную спектроскопию автофлуоресцентных сигналов, собираемых на различных глубинах (от 0 до 50 и от 100 до 150 микрометров) с использованием облучающих волн на длинах от 730 до 960 нанометров. Наблюдения велись в сочетании с отражательной конфокальной микроскопией. Комбинацией двух методов удалось без нанесения вреда образцу получить подробные автофлуоресцентные снимки и снимки в отраженном свете слоев кожи одного и того же участка.
Двухфотонное возбуждение позволяет избежать фототоксических эффектов ультрафиолетового облучения для образцов, возбуждаемых в этом диапазоне. Это свойство особенно важно при визуализации естественно возникающих восстановленных пиридиннуклеотидов (NAD(P)H) как индикаторов клеточного дыхания. Поскольку NAD(P)H имеет малое сечение поглощения и низкий квантовый выход, а поглощает в ультрафиолетовой области спектра, его трудно возбудить и измерить, не нанеся, к тому же значительного фотоповреждения. Визуализация NAD(P)H применялась при изучении патофизиологии культивируемых частично дифференцированных L6 клеток мышечной трубочки. Автофлуоресцентное свечение на снимках клеточных NAD(P)H первоначально отражало NADH в митохондриях в виде пятнистых участков на фоне рассеянного цитоплазматического сигнала. В дифференцированных клетках флуоресценция наблюдалась в виде колонн митохондрий локализованных между полосок мышечного волокна, а увеличение флуоресценции соответствовало увеличению концентрации глюкозы. В этом исследовании была продемонстрирована однородность метаболизма глюкозы и возможность исследования кинетики использования глюкозы в реальном времени либо в одной клетке, либо по усредненному значению по нескольким клеткам.
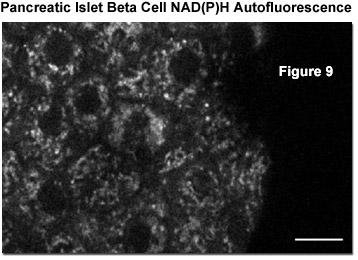
Дополнительные исследования, опубликованные в научной литературе, были посвящены количественной двухфотонной визуализации NAD(P)H и сосредоточены на отдельных бета-клетках в панкреатическом островке, который представляет собой квази-сферический микроорган, состоящий примерно из 1000 клеток. Пространственное разрешение при визуализации двухфотонным методом всех нуклеотидов позволяет различать цитоплазматические и митохондриальные сигналы NAD(P)H. На рисунке 9 представлен типичный снимок автофлуоресценции NAD(P)H бета-клеток в интактном островке, сформированный сигналами, как из цитоплазмы, так и из митохондрий (последние светлей и несколько пятнистей). Видны контуры отдельных клеток, а также их ядра, темные для клеток обоих типов. Благодаря разделению цитоплазматического и митохондриального сигналов из бета-клеток панкреатического островка, стало возможным подробное изучение обмена глюкозы и пирувата.
В современных моделях глюкозо-стимулируемой секреции инсулина (ГССИ) предполагается, что метаболиты, расположенные далее по пути сигнальной трансдукции, должны стимулировать аналогичный каскад сигнальный событий и вызывать секрецию инсулина; хотя, сам по себе, пируват и не индуцирует секрецию инсулина, но он усиливает ГССИ. В обсуждаемом исследовании двухфотонное возбуждение использовалось для визуализации NAD(P)H и разделения цитоплазматических и митохондриальных сигналов, чтобы продемонстрировать, что бета-клетки усваивают пируват, хотя и кратковременно. Такая кратковременная митохондриальная реакция предполагает две различные модели, изучаемые в настоящее время: на поздней стадии метаболизма пирувата подавляется либо перенос пирувата в митохондрии, либо трикарбоновый цикл. С помощью метода двухфотонного возбуждения живые панкреатические островки неоднократно сканировались для получения данных в интервалах дискретизации, что невозможно биохимическими методами. Неоднократная визуализация такого рода была бы просто невозможна с помощью конфокальной микроскопии из-за ограничений, накладываемых фотообесцвечиванием фотоповреждением, вызываемым ультрафиолетом.
Поскольку в микроскопии с двухфотонным возбуждением применяются лазеры с синхронизованными модами (импульсные), она может легко использоваться в комбинации с визуализацией изображений в течение времени высвечивания. Снимки, полученные на основе наносекундного затухания флуоресцентного свечения, дают информацию, независимую от концентрации флуорофоров. Одним из возможных приложений визуализации в течение времени высвечивания является получению точного значения эффективности резонансного переноса энергии флуоресценции (FRET) между двумя красителями-зондами. В недавнем исследовании визуализация в течение времени высвечивания была реализована на двухфотонном микроскопе для количественного определения концентрации NAD(P)H в различных внутриклеточных компартментах. Свободные уровни NADH в ядрах регулируют корепрессор CtBP, участвующий в клеточном цикле регуляции и трансформации транскрипционных путей. Одновременное применение к исследованию NAD(P)H микроскопии с двухфотонным возбуждением и визуализации в течение времени высвечивания показало, что уровни свободных NADH соответствуют половине максимальной концентрации CtBP.

Рис. 8. Детектирование рассканированного и нерассканированного сигнала
Метод двухфотонного возбуждения может быть объединен со многими другими разработанными биофизическими методиками, включая флуоресцентную корреляционную спектроскопию (FCS) и восстановление флуоресценции после фотообесцвечивания (FRAP). В каждой из этих методик обычно применяется стационарные однофотонные (непрерывного излучения) лазеры. Методом ФКС определяются диффузионные характеристики и число задействованных флуоресцентных зондов в фокальном объеме непрерывного освещающего пучка. Она была успешно применена в исследованиях молекулярного взаимодействия и диффузионных свойств. Контролирование фотообесцвечивания флуоресценции в области лазерного фокуса с последующим восстановлением флуоресценции (FRAP) применялось для изучения макроскопической диффузии флуоресцентных молекул. Как ФКС, так и FRAP широко применялись для исследования диффузионных характеристик флуоресцентных зондов на мембранах культивируемых клеток. На сегодняшний день сложность этих методик ограничивает их применение в системах in vitro и в экспериментах с клеточными культурами. Когда в любой из этих методик требуется получить количественные данные, лучше воспользоваться преимуществами микроскопии с двухфотонным возбуждением, в которой точно определяется область возбуждения. К тому же ФКС и FRAP могут оказаться весьма ценными при изучении биомолекулярной динамики в толстых живых тканях, если их применять с двухфотонным, а не однофотонным возбуждением.
Глубокое проникновение, доступное при двухфотонном возбуждении, позволяет проведение визуализации in vivo, хотя при наблюдении живых животных и необходимо преодолеть ряд трудностей. Наблюдение флуоресценции in vivo при двухфотонном возбуждении может осуществляться через хирургические вскрытия кожи живого животного или через помещенные на животное покровные «окна». Значительную дополнительную трудность при работе с живыми животными представляет флуоресцентное окрашивание образца. В одном опубликованном исследовании сообщалось об использовании Ca2+ индикатора для специфического окрашивания нейронов живой мыши, позволяющем следить за функционированием нервной системы с помощью двухфотонного возбуждения. Экспрессия зеленого флуоресцентного белка (GFP) в трансгенных животных для флуоресцентного окрашивания отдельных органов или белков должна обязательно привести к дополнительному применению двухфотонного возбуждения для визуализации in vivo. Поскольку при наблюдении живых образцов существует вероятность того, что они могут двигаться, большинство исследований проводятся под наркозом, а скорость визуализации увеличивается, чтобы уменьшить влияние этого движения. Не исключено, что будущие технологические достижения, такие как миниатюризация двухфотонных микроскопов для их непосредственного прикрепления к живым образцам, позволит наблюдать свободно двигающихся животных.
Некоторые исследователи применили ввод большого количества кальциевого индикатора для наблюдения его с помощью микроскопии с двухфотонным возбуждением, чтобы составить карту микросхем нейронов в мозговом срезе мыши. Их метод заключался в том, чтобы запустить сигнальные нейроны, а затем фиксировать кальциевые сигналы, инициированные при взаимодействии с так называемыми «ведомыми» нейронами. Было установлено, что неокортекс состоит из множества точно организованных микросхем. Ведомые принадлежали к нескольким анатомическим классам, их положения были определены и могли быть предсказаны для различных животных.
Потенциально очень мощным приложением микроскопии с двухфотонным возбуждением является трехмерно-разрешимое фотовысвобождение связанных соединений, называемое высвобождением. Количественно заданное высвобождение кальция двухфотонным возбуждением, например, является основой многих методик. Как говорилось выше, фотохимическое высвобождение происходит достаточно медленно (от миллисекунд до секунд), что позволяет соединению-мишени за время между возбуждением и активацией диффундировать в образце на несколько микрометров. В некоторых приложениях, таких как «маркировка» клетки высвобождением нестойких флуоресцентных молекул мембраны, диффузия не является проблемой. Одной группе исследователей удалось применить фотовысвобождение двухфотонным возбуждением в сочетании с конфокальной микроскопией для того, чтобы проследить последовательность клеточных поколений в развитии эмбриона морского ежа.
Молекулы с быстрым высвобождением с успехом были использованы другими исследователями в работах по высвобождению стимуляторов, где они применили двухфотонное возбуждение для составления карты нейронных рецепторов. С учетом преимуществ трехмерного характера двухфотонного возбуждения, фотохимическое высвобождение было использовано также и для определения местоположения высвобожденных стимуляторов в визуализируемой среде. При высвобождении стимулятора около мембраны клетки он стимулировал рецепторы в непосредственной близости от себя, и это регистрировалось фиксацией потенциала клетки. При визуализации этого типа изображение составлялось не по испущенным фотонам, а скорее по измеряемой реакции на возбуждение. В качестве успешного примера можно привести составление карты глутаматных рецепторов регистрацией сигналов от высвобожденного MNI-глутамата в сочетании с фиксацией в конфигурации «whole-cell». Образцами выступали тонкие срезы культурных гиппокампальных нейронов и гиппокампальных CA1 пирамидальных нейронов. Исследователям в этой работе удалось получить превосходные боковые (0,6 мм) и продольные (1,4 мм) значения диаметров полной ширины на полувысоте максимума (ПШПВ), свидетельствующие о быстром протекании реакции высвобождения. В последствии им также удалось установить, что глутаматные рецепторы типа AMPA (амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) присутствуют в больших количествах в грибовидных шипиках, и что распределение этих рецепторов в значительной степени коррелирует с геометрией шипиков.
Заключение
Микроскопия с двухфотонным возбуждением оказывается чрезвычайно полезной при динамической визуализации живых клеток в толстых образцах, особенно в интактных тканях. Благодаря этому методу стало возможным проведение многих экспериментов, невыполнимых традиционными методами, или в которых этими методами не удавалось получить необходимую информацию. Благодаря способности лазера с синхронизованными модами (импульсного лазера) создавать достаточную плотность фотонов в фокальной точке, двухфотонное возбуждение происходит лишь в фокальной плоскости. Преимущество локализованного возбуждения состоит в том, что испускание света ограничено узкой фокальной областью, что избавляет от необходимости использования точечной диафрагмы. Более того, ограниченная область возбуждения уменьшает фототоксичность исследуемых тканей, поскольку фотоповреждение в значительной степени ограничено фокальным участком.
Хотя микроскопия с двухфотонным возбуждением не дает более высокого разрешения изображения, чем конфокальная микроскопия, она позволяет проникать в толстые образцы на большую глубину. Большая глубина проникновения возможна частично из-за геометрии «открытой» точечной диафрагмы в двухфотонном микроскопе, а также благодаря отсутствию внефокусного поглощения возбуждающего света и его меньшему рассеянию (из-за большей длины волны). Чтобы в полной мере воспользоваться возможностью глубокого проникновения, необходимо использовать конфигурацию детектирования нерассканированного сигнала, которая позволяет значительно повысить эффективность приема рассеянных флуоресцентных фотонов. Преимущества двухфотонного возбуждения уже не требуют подтверждений и позволяют проводить эксперименты, невыполнимые с помощью конфокальной микроскопии. Этот метод становится все более популярным благодаря технологическим достижениям и удешевлению оборудования, поэтому число интересных экспериментальных открытий, полученных с его помощью, скорее всего, будет расти.