|
|
|
|
|
Прямой лабораторный микроскоп CX43 Доступно: светлое поле (BF), тёмное поле (DF), флуоресценция (FL), поляризация (POL), фазовый контраст (PH) |
Прямой исследовательский микроскоп BX43 Доступно: светлое поле (BF), тёмное поле (DF), флуоресценция (FL), поляризация (POL), ДИК (DIC), фазовый контраст (PH) |
Инвертированный микроскоп IX53 Доступно: светлое поле (BF), флуоресценция (FL), контраст Хоффмана (RC), фазовый контраст (PH) |
Микроскопия для микробиологического исследования имеет ряд ключевых методик для грамотного анализа образцов. Отличительные особенности бактериологического исследования отражаются и в комплектующих необходимых для проведения работ. Основные методики исследования бактерий это светлопольное и темнопольное наблюдение, фазовый контраст, дифференциально интерференционно-контрастная микроскопия, поляризация, флуоресценция и конфокальная микроскопия. Данные методики позволяют повысить чёткость увеличенного изображения бактерий для определения их колоний, формы, морфологических признаков и структур. Каждая методика наблюдения требует наличия определенных конструктивных элементов на рабочих микроскопах. Микроскопы могут как специализироваться на одной конкретной методике исследования, так и быть универсальными, на которых при желании могут добавляться дополнительные принадлежности для осуществления того или иного метода микроскопии.
Размеры микроорганизмов могут колебаться в пределах от 0,7 мм до 0,3 мкм. Варьирование размеров до трёх порядков ведёт к необходимости наличия большого диапазона увеличения объективов. Типы световых микроскопов в зависимости от конструкции разделяются на две большие группы- прямые и инвертированные. В прямых, как в Olympus CX23. объектив находится над препаратом. В инвертированных микроскопах, как в Olympus IX53 объектив расположен с нижней стороны предметного столика, соответственно, конденсор освещает исследуемый образец сверху. Данная конструкция микроскопа наиболее удобна для исследования микроорганизмов и культур непосредственно в лабораторной посуде, через прозрачное дно посуды. Последний способ реализован в моделях инвертированных микроскопов Olympus серии IX и в модели CKX53. Так же для работы с живыми культурами компания Olympus предлагает воспользоваться CO2-инкубатором cellVivo, устанавливаемый на модели серии IX73. Удобство в его использовании заключается в возможности проводить наблюдения и исследования с микроорганизмами в режиме on-line.
Методики, утверждённые ГОСТом, нередко требуют наличия конкретных характеристик у микроскопов для проведения анализов. Например:
- Микроскоп световой биологический с приспособлением для фазово-контрастного микроскопирования (ГОСТ 10444.11-89 "Продукты пищевые. Методы определения молочнокислых микроорганизмов") (ГОСТ 10444.9-88 "Продукты пищевые. Метод определения Сlostridium perfringens")
- Микроскоп биологический с оптической системой в плоском поле зрения диаметром 1,382 мм, с передвижным столиком снабженным нониусом и препаратоводителя. (ГОСТ 10444.14-91 Метод определения содержания плесеней по Говарду.)
- Микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 90х- 1000х. (ГОСТ 31746-2012 (ISO 6888-1:1999, ISO 6888-2:1999, ISO 6888-3:2003) Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus)
- Микроскоп световой биологический , обеспечивающий увеличение 900-1000х. (ГОСТ 29185-91 "Продукты пищевые. Методы выявления и определения количества сульфитредуцирующих клостридий")
- Микроскоп биологический с приспособлением для фазово-контрастного микроскопирования, обеспечивающий увеличение 900-1000 (ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности)
- Микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 900(х) - 1000(х) с иммерсионной системой или с приспособлением для фазово-контрастного микроскопирования. Прибор для подсчета колоний микроорганизмов (Мясо и мясные продукты. Общие требования и методы микробиологического анализа. ГОСТ р 54354-2011)
Светлопольная микроскопия является одним из основных методов лабораторного анализа микроорганизмов. Суть метода заключается в наблюдении окрашенного препарата в видимом спектре. Человеческий глаз легко улавливает изменения световой волны, проходящей через окрашенный препарат. Наблюдение возможно, если яркость отдельных участков препарата имеет достаточную разность интенсивности, для восприятия наблюдателем или камерой. Наиболее подходящими под данную методику являются оптические микроскопы моделей BX43, BX53 компании Olympus.
Разрешающая способность светового микроскопа определяется при прочих равных условиях апертурой микроскопа. Для увеличения разрешающей способности прибегают к помощи иммерсии. Размещённое между объектом наблюдения и объективом иммерсионное масло имеет показатель преломления выше чем воздух, тем самым уменьшает потери светового пучка при рассеивании. С помощью неё. можно рассмотреть объекты размером до 0,2 мкм, что соответствует пределам размеров микроорганизмов, и их легко наблюдать в световом иммерсионном микроскопе.
Микроорганизмы, как правило, бесцветные полупрозрачные организмы для эффективного наблюдения которых необходимо прибегать к таким дополнительным методам, как окрашивание препарата. Красители повышают контрастность мембраны, либо органелл (жгутики, в окрашивании по методу Бениньетти) бактерий. Методика окрашивания может содержать в себе простой способ, с одним красителем (метод Леффлера), либо сложные (окрашивание по Цилю-Нильсону, по Граму) представляющие собой дифференциальные диагностические методы окрашивания препаратов с помощью нескольких красителей, один из которых является основным, другой, дополнительным красителем- контрастом. Все вышеперечисленные методы относятся к позитивным- когда окрашивается сам препарат наблюдаемый на освещённом фоне микроскопа, но так же есть негативные методы (способ Бури), когда жидкой тушью заливается сам фон, на котором просматриваются более светлые. бесцветные бактерии.
Темнопольная микроскопия используется при наблюдении прозрачных неабсорбирующих объектов, которые невозможно рассмотреть методом светлого поля. Она основана на сильном рассеивании света наблюдаемым объектом, известным под названием эффект Тиндаля. Для осуществления метода необходимо наличие специального оборудования в микроскопе- темнопольного конденсора, объективы при этом остаются обычными. Исследуемый объект освещается косопадающим освещением, при котором поверхность может рассеивать лучи и в них наблюдатель и исследует объект. Такое освещение – есть EPI подсветка.

Daphnia obtusa при а) светлопольном и b) темнопольном микроскопированию
Темнопольная микроскопия позволяет наблюдать фактурные неоднородности поверхности. С задачами темнопольного микроскопирования отлично будет справляться серия микроскопов Olympus моделей CX43, BX43, BX53.
Фазово-контрастная микроскопия в отличие от темнопольного метода, позволяет рассмотреть слабоконтрастные структуры неокрашенных препаратов. Метод основан на регуляции изменении фазы световых волн, которые преобразуются в изменение интенсивности (амплитуды) световой волны уже различаемым глазом. Достигается это с помощью специальной системы колец в конденсоре и объективе, которая реализуется двумя типами: внутренним способом и внешним. Внутренний способ предполагает наличие специального фазового объектива и конденсора, внутри которых, находятся фазовые кольца, соответствующего друг другу размера.
Флуоресцентная (люминесцентная) микроскопия занимает особое место среди микроскопии. Так как не все микроорганизмы способны самостоятельно люминесцировать, есть необходимость подвергать их дополнительной обработке: флюорохромированию- окрашиванию люминесцирующими красителями, либо имуннофлюоресценции, где люминесценции достигают через реакцию меченых флуорохромами антител. Многие современные исследования бактерий включают в себя иммунофлуоресцентный анализ, где стекла просматривают под флуоресцентным микроскопом с фильтрами, подходящими для излучения FITC (Флуоресцеин изотиоцианата), с масляной иммерсией и увеличением от 500 до 1000 раз. В комплектацию люминесцентного микроскопа в отличии от обычного, входит мощный источник света, излучающий в широком спектре диапазоне, или в конкретной части спектра. Флуоресцентный метод использует закон Стокса, согласно которому длина волны люминесцентного испускания препарата больше длины волны возбуждения за счет потери энергии при переходе электронов в основное состояние. Так, если возбуждать люминесценцию в препарате синим цветом испускаемый спектр будет находиться от зелёного до красного, при возбуждении УФ-излучением- испускание может находиться в любой части видимого спектра. Флуоресцентный микроскоп комплектуется различными наборами фильтров обеспечивающие освещение препарата с заданной длиной волны и пропускающая в окуляры только длину волны свечения препарата. Задача исследователя- оценить характер свечения, форму, размеры и взаимное расположение микроорганизмов в препарате. Люминесценцию в микроскопировании наблюдают как в проходящем, так и в падающем свете. Методом флуоресценции выделяют анаэробные бактерии, как например, Fusobacterium Prevotella, в которых присутствует флуорохромное вещество. Белки связываются с флуорохромами образуя стойкие комплексы, видимые в люминесцентном микроскопе. Для осуществления данного метода необходимо наличие микроскопа включающей в себя мощный источник света, в большей мере в коротковолновой части спектра и наличие системы фильтров. Данная методика может осуществляться на микроскопах фирмы Olympus, моделях CX43, BX43, BX53, BX63, CKX53, IX53, IX73, IX83. Модели CKX53 и CX43, являются прекрасным решением для оснащения ветеринарных лабораторий. На них осуществляются исследования по методу темного поля, фазового контраста и флуоресценции, которые полностью покрывают требования к выполнению основных рутинных исследований в области ветеринарии. Особенно полезным является используемый в микроскопах метод FITC для диагностики бешенства. Данные характеристики делают CX43 и CKX53 незаменимым оборудованием в современной лаборатории.
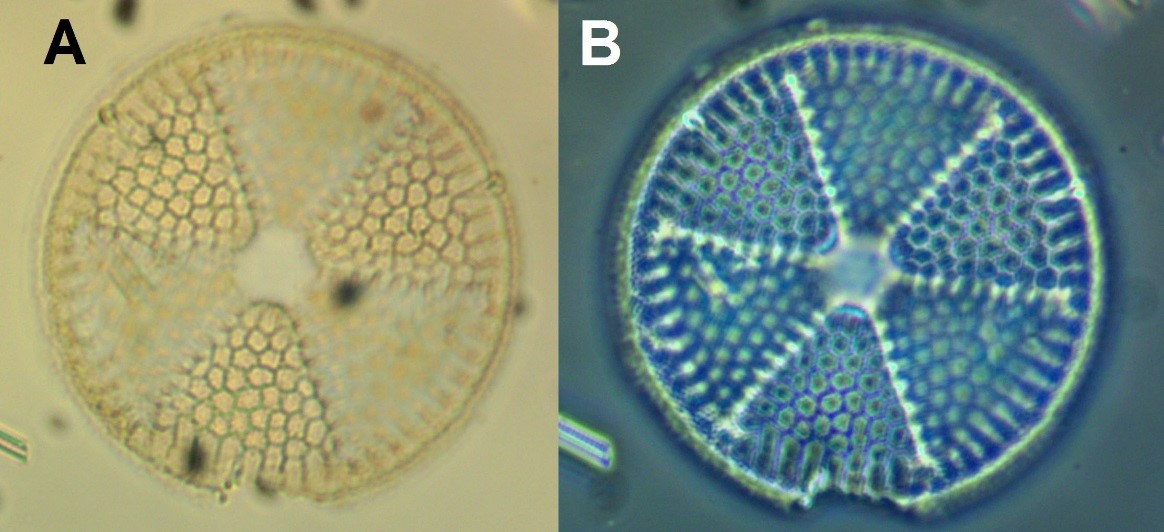
Диатомовая одноклеточная водоросль при микроскопировании, а) светлое поле, в) фазовый контраст
Контраст Хоффмана или модуляционный контраст Хоффмана, так же известный как рельефный контраст - это метод позволяющий рассмотреть неокрашенные препараты с помощью косого освещения, создающий градиент оптических фаз. Препарат становится более контрастным за счет образования светящего гало по границам рассматриваемого объекта. С помощью данного метода можно наблюдать в более рельефном виде витальные (живые) препараты, которые могут находится как в стеклянной, так и в пластиковой посуде. Для осуществления данного метода среди линейки микроскопов Olympus требуется инвертированный исследовательский микроскоп, в конструкцию которого необходимо включить дополнительные элементы. Для реализации рельефного контраста необходимы объективы серии RС, конденсор со специальной вставкой и поляризатор. Рельефный контраст успешно используется на микроскопах IX53, IX73. IX83.
Поляризационная микроскопия является одним из важнейших методик при проведении лабораторных анализов. К данном числу относится диагностика подагры, силикоза, и других показателей, исследуемых, например, в осадке мочи. Без поляризационного анализа невозможен ряд исследований, проводимых в судмедэкспертизе и криминалистике. Суть метода состоит в изучении биологических структур с анизотропными свойствами: это различные кристаллы солей, волокна, липоиды, холестерин и др. Видимый свет преобразуется в поляризованный в специальном устройстве- поляризаторе. который помещается между осветителем и исследуемым препаратом. Второй поляроид, анализатор, располагается между препаратом и объективом с возможностью вращения и соответствующей градуировочной шкалой. Данные вставки могут быть изначально встроены в конденсор и в слот револьвера, соответственно. При скрещивании плоскостей поляризаторов относительно друг друга, анизотропные вещества наблюдаются как светлые объекты на тёмном фоне. Данная методика исследования осуществляется на ряде моделей микроскопов Olympus, таких как BX53, BX43, CX43.
Дальнейшая эволюция методики фазово-контрастной микроскопии привела к образованию нового типа микроскопирования, а именно, DIC- микроскопии, или дифференциальной интерференционно-контрастной микроскопии. Главным отличием является преодоление дифракционного гало, которое присутствует в первом случае. В основе метода так же присутствует поляризованный источник света, который разделяясь на два луча, проходящие различные оптические пути, снова интерферируют при слиянии. Данный способ подходит для рассмотрения витальных (живых) полупрозрачных клеток создавая чётко очерченное фактурное изображение с характерным рельефом соответствующей различной оптической плотности образца. Стоит заметить, что данная технология работает только со стеклянной посудой, или специальной пластиковой которая не искажает поляризованный свет. Для осуществления метода необходимо иметь специально оборудованный микроскоп, включающий в себя такие конструктивные элементы как поляризатор и анализатор, ДИК-призму в конденсоре, ДИК-слайдеры устанавливаемые в револьвер микроскопа и объективы план-флюориты. Отдельно следует осветить вопрос преимущества апохроматических объективов, которые имеют большие значения числовых апертур. Исправленные сферические и хроматические аберрации, особый состав оптических стёкол для линз, исправлен вторичный спектр способствуют повышенной чёткости изображения и цветопередачи, особенно при использовании ДИК-микроскопии. Соответствующая комплектация есть в моделях микроскопов Olympus BX53 со всеми необходимыми комплектами призм и объективов.
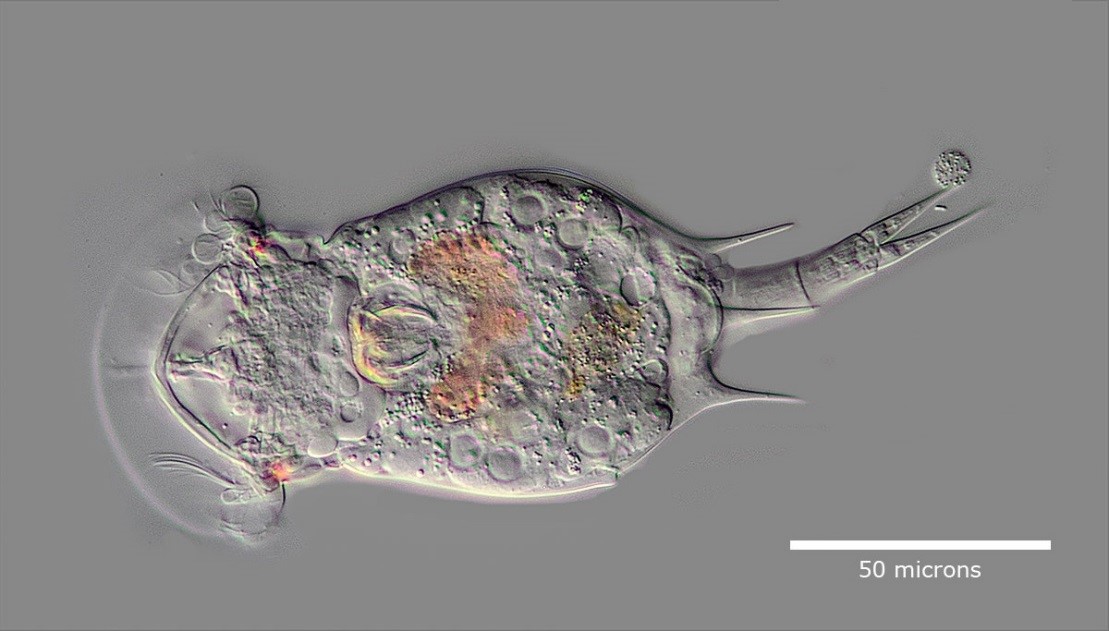
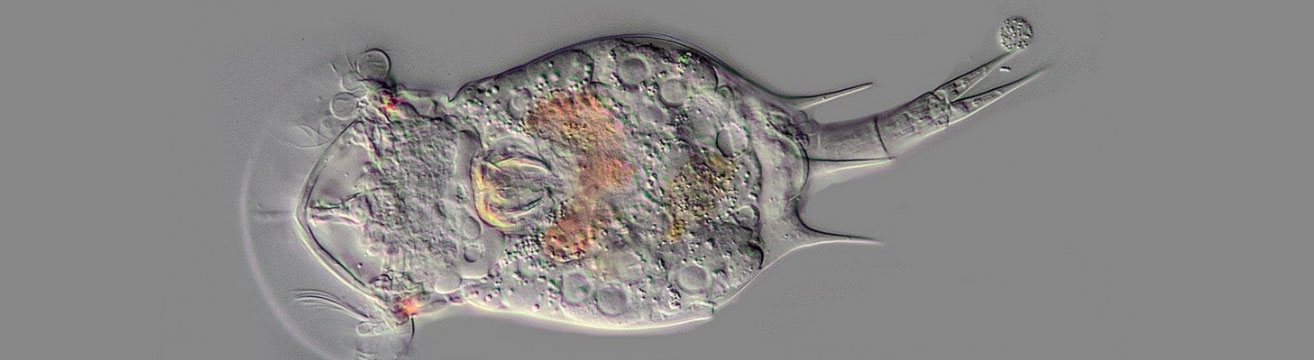
Squatinella rostrum в дифференциальной интерференционно-контрастной микроскопии
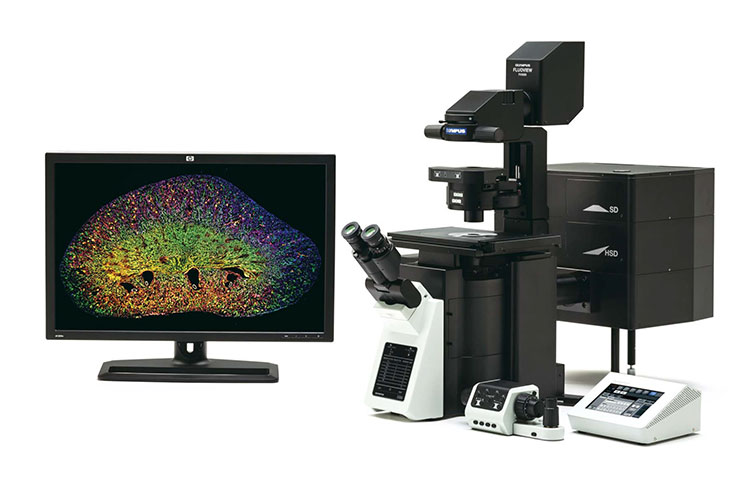
Конфокальная микроскопия представляет собой этап развития микроскопирования в которой источником света является лазер, Точечный детектор регистрирует возбуждение объекта от лазерного луча в пространстве и времени. Полученное изображение состоит из различных по глубине секций, что позволяет создать трёхмерное изображение объекта. Данный способ обеспечивает наивысшую разрешающую способность в биологических исследованиях.
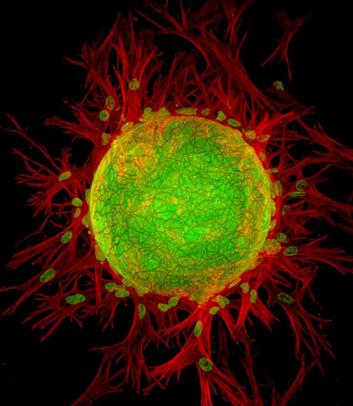
Конфокальное и флуоресцентное изображение лимфатических эндотелиальных клеток и фибробластов. 200-кратное увеличение
Все перечисленные методы микроскопирования широко распространены в научных и рутинных лабораторных исследованиях. Качество выполняемых работ напрямую зависит от оборудования, на котором оно осуществляется. Совершенствование методик невозможно без подключения и внедрения нового оборудования и материалов в аппаратном обеспечении и комплектации приборов. Особенно, если это касается такой немаловажной сферы исследования, как биологические науки.