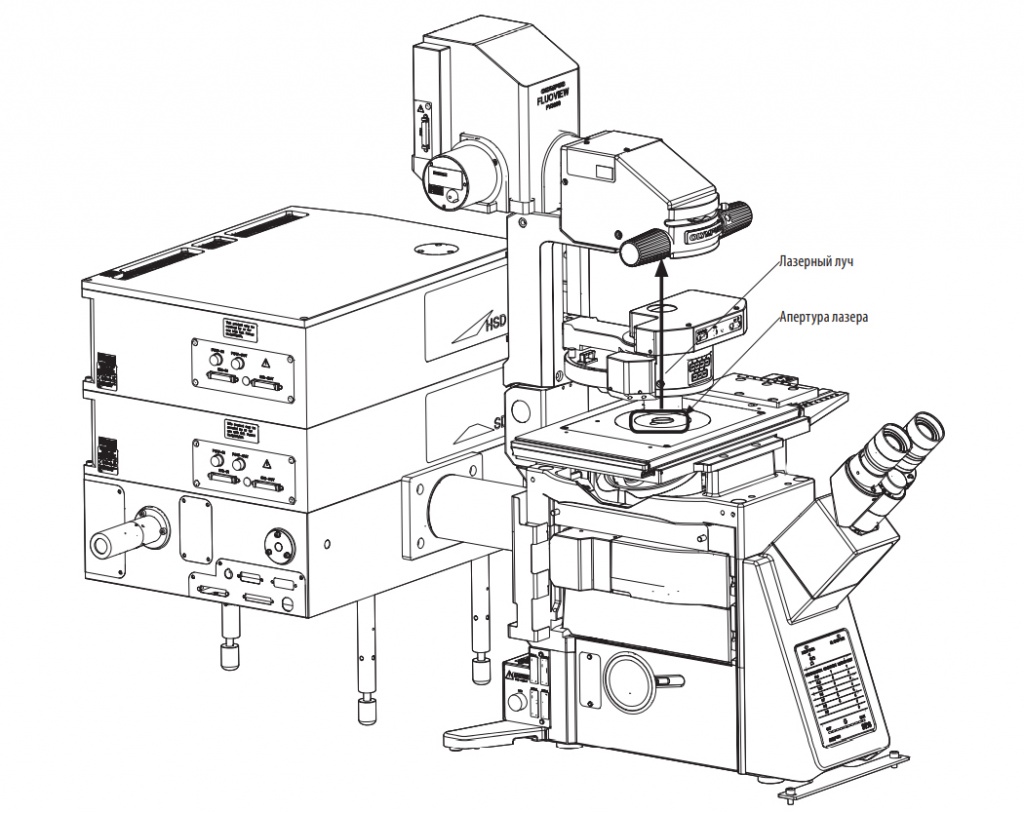
Лазерный сканирующий микроскоп — это система, проводящая трёхмерное сканирование и отсекающая фоновую засветку, для получения увеличенных изображений с высокими показателями пространственного разрешения и контрастности.
Применение лазерных микроскопов
Лазерная сканирующая конфокальная микроскопия (LSCM) предлагает несколько преимуществ по сравнению с обычной световой оптической микроскопией: возможность контролировать глубину резкости, устранять или уменьшать фоновую информацию вдали от фокальной плоскости и собирать последовательные срезы с объёмных образцов in vivo. Однако это точечное отверстие отображает только небольшую площадь предмета (около 100 нм) и, следовательно, должно быть отсканировано по всему предмету исследования, что требует времени и может привести к повреждению фотографии.
Лазерный микроскоп используют везде, где необходимо визуализировать, сохранять, в высоком разрешении, различные компоненты живых или фиксированных клеток и тканей, специально меченных флюорохромами. Для толстых объектов: сфероиды, органоиды, ткани и мелких животных, используют флуоресцентную микроскопию плоскостного освещения LSFM.
При внесении изменений в конструкцию, адаптации для материаловедения, конфокальный микроскоп является стандартным прибором для исследований в полупроводниковой промышленности, металлографии и других отраслях материаловедения. Дает максимально точную информацию о рельефе поверхности, строит профиль с разрешением до 5 нм, поэтому второе название этих систем – оптические профилометры.
Устройство лазерного микроскопа
Принцип работы лазерного микроскопа состоит в создании трехмерного образа за счет так называемых «оптических сечений» с использованием специальный флуоресцентных объективов с линзами из низкодисперсионного стекла. Прежде чем быть зафиксированной детектором или высокочувствительным фотоприёмником, флуоресценция улавливается объективом, ретранслируется обратно через сканирующие зеркала и через главное дихроичное зеркало. Оно отражает более короткие длины волн, такие как луч лазерного возбуждения, и пропускает более длинные волны, образованные Стоксовым сдвигом.
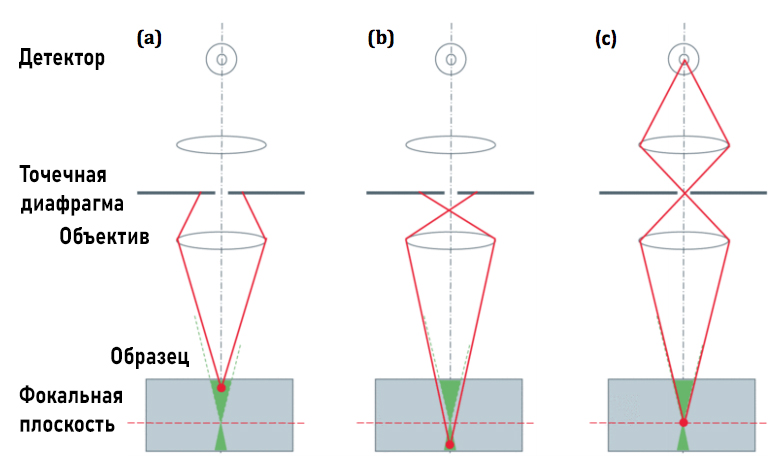
Рисунок 1: Использование точечной диафрагмы для блокирования паразитной засветки. Свечение выше (а) или ниже (б) фокальной плоскости, в то время как луч (в) проходит к детектору.
Длинноволновый сигнал затем передается на пару линз по обе стороны от pinhole точно сопряженного с фокальной плоскостью линзы объектива. Фотоны, собранные из объема объекта, коллимируются линзой объектива и фокусируются конфокальными линзами, создавая оптический разрез, в котором виден только свет из фокуса микроскопа. Поэтому флуоресценция, генерируемая выше или ниже, не будет правильно сколлимирована. Таким образом, pinhole эффективно действует как виртуальная апертура, ограничивая детектируемое излучение только одним ограниченным пространственным местоположением. Но это применимо для визуализации тонких образцов, а толстые становятся размытыми, засвеченными.
Их система сконструирована таким образом, чтобы из всего образца был виден только ультратонкий слой на заданной глубине, без лишней информации, расположенной вне области схождения, а объём картинке придаёт наложение снимков всех слоёв объекта. При необходимости, во время сканирования, могут использоваться дополнительные методы контрастирования для выделения изучаемых структур или отсечения ненужных данных.
В работе с конфокальными микроскопами используются специальные программы, с помощью которых создаются объемные изображения из серии снимков микропрепарата и рассматривать их под разными углами, они анализируют внутриклеточные структуры и отвечают за автоматизацию всех рабочих систем. Благодаря послойному просмотру препарата появилась возможность оценивать такой процесс, как морфокинетика клеточного деления, исследовать фрагменты цитоскелета, изучать адгезии и межклеточные взаимодействия, измерять проницаемость цитоплазматических и митохондриальных мембран и т.д. Для работы конфокальных систем не требуется вакуум, благодаря чему, образ делается в реальном времени, осуществляя наблюдение в цвете.
Дополнительно используются различные методы: поляризация, фазовый и интерференционный контрасты. Пригоден для количественных исследований свойств материалов и веществ. Характеризуется максимально высоким разрешением для оптических микроскопов и максимальной глубиной резкости 3D моделей.
Особенности применения лазерной микроскопии
В современных серийных комплексах конфокальной микроскопии полностью автоматизированы процессы: подачи, перемещения, смены длины волны и интенсивности возбуждения, смены увеличения, контроля температуры объекта, газового состава внутри инкубатора, сканирования, обработки полученных данных и подготовки отчётности. Особенности этого класса оборудования не позволяют применять все доступные возможности в прикладных задачах in vivo, в виду особой подвижности живых организмов. Послойное сканирование с последующей компиляцией 3D изображения на основе данных снимков невозможно на быстродвижущихся объёмных объектах из-за разного положения цели на сделанных снимках.
Темп сканирования до сих пор является одним из самых больших недостатков конфокальной микроскопии. Как указано выше, излучение лазера, концентрируется в очень маленьком месте. Это пятно перемещается с очень высокой скоростью по одной оси и выглядит невооруженным глазом в виде линии. Затем эта «линия» перемещается по другой оси для медленного сканирования образца. Для манипулирования положением светового пятна используется несколько подходов и технологий; к ним относятся: гальванические зеркала, гальванические резонансные зеркала, шестиугольные призмы или вращающиеся диски.
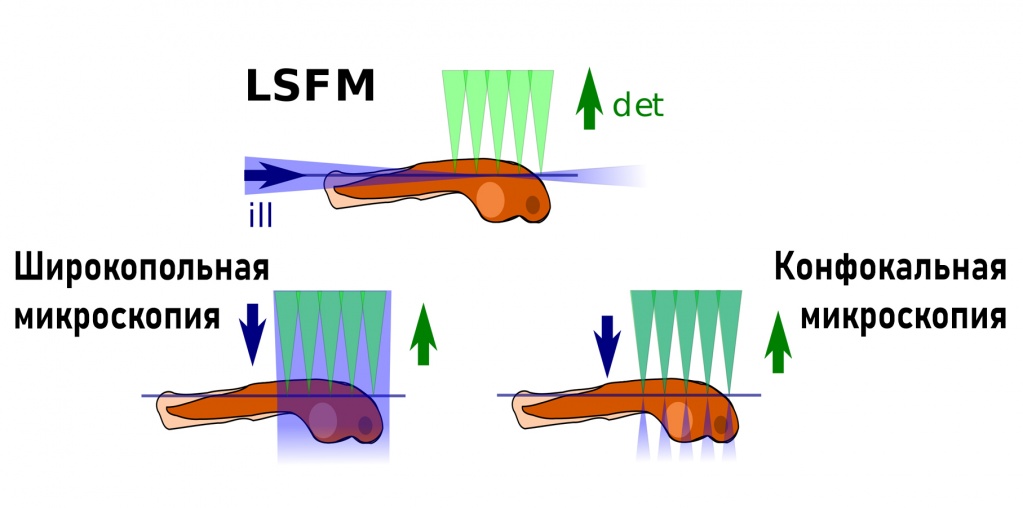
Проблема быстроты сканирования подвигла учёных к созданию метода флуоресцентной микроскопии плоскостного освещения, также называемая одноплоскостной микроскопией освещения или SPIM. LSFM является щадящим способом визуализации чувствительных проб или быстрых биологических процессов in vivo. Предмет освещается только в одной области за один раз и обнаруживается с перпендикулярного направления. Поскольку не наблюдается расфокусированного возбуждения, фототоксические эффекты сводятся к фокальной плоскости. Изображение светового листа имеет внутреннее оптическое сечение.
Вращающаяся дисковая конфокальная микроскопия
Микроскоп со спиннинг диском (SDCM) представляет собой альтернативу LSCM. Вместо одного точечного отверстия, у SDCM имеется их сотни, расположенных по спирали на непрозрачном диске (рисунок 2), который быстро вращается. При раскрутке эти щели сканируют элементы рядами, создавая изображение. Использование такой конструкции значительно повышает скорость получения картинки и значительно снижает повреждение фотографий.
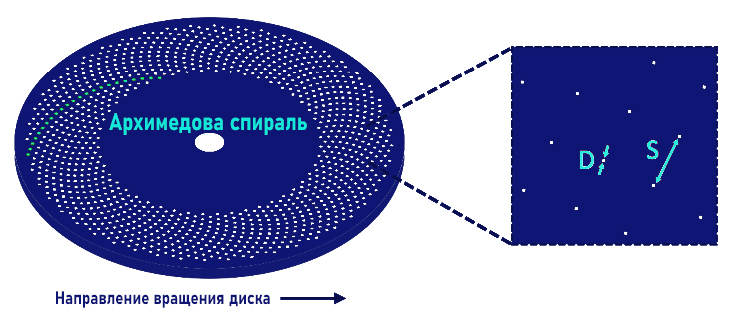
Рисунок 2: Стандартный диск Нипкова-Петрана, используемый в SDCM. Сотни точечных отверстий расположены в архимедовых спиралях (слева), которые проходят над образцом по мере его вращения. Они имеют диаметр D и расстояние разделения S, изменение этих значений может оптимизировать полученный рисунок.
Каналы в диске расположены так, что каждая часть субстанции сканируется по мере ее движения. Путем изменения их скорости вращения, диаметра и расстояния между ними; яркость, контрастность и качество проекции могут быть оптимизированы, что делает SDCM легко настраиваемыми. Большие диаметры приводят к улучшению пропускания фотонов и большое расстояние между отверстиями устраняет любые перекрестные помехи.
Наличие небольших щелей с большим расстоянием приведет к более высокому разрешению, но самой низкой интенсивности. Коэффициент пропускания улучшается с добавлением второго диска, который содержит линзы микрометрового масштаба. Эти микролинзы фокусируют свет через каждое окно первичного диска, что значительно улучшает его пропускание к образцу, как показано на рисунке 3.
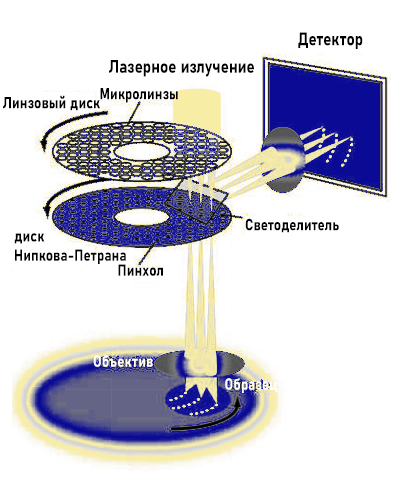
Рисунок 3: Использование вторичного микролинзового диска для улучшения пропускания света через первичный. Лазерное освещение фокусируется через микролинзы, движение происходит синхронно над покровным стеклом.
Образ, полученный от Graf et al. 2005.
Камеры для вращающихся дисковых конфокальных микроскопов
Важным моментом, который следует учитывать, является то, что SDCM изменяют несколько точек одновременно и могут вращаться на очень высоких скоростях, а это означает, что для захвата изображений из образца необходимы высококачественные научные камеры. Эти камеры должны иметь высокую частоту кадров из-за быстроты вращения, потому что более длительное время экспозиции или медленная скорость приводят к полосатой картинке. С помощью камер, которые соответствуют требуемой скорости, получаются высококачественные проекции, как показано на рисунке 4.

Рисунок 4: Влияние скорости вращения диска и времени экспозиции на результирующий образ. Слева направо показано увеличение времени экспозиции и темпа вращения, что приводит к более чистому изображению без полос. Шкала 10 мкм.
Получено от Stehbens et al. 2012.
Отличительной особенностью лазерных конфокальных микроскопов является использовании в их работе лазера и точечной диафрагмы – пинхола. Лазер — это устройство, которое преобразует энергию, и оно способно излучать кванты с различными длинами волн. Благодаря лазеру и диафрагме фокусировка осуществляется в определенной точке, а не освещает все поле зрения. Это позволяет проводить более эффективную работу, снижает количество бликов и увеличивает точность фокусировки пучка электромагнитных волн. Изменения диаметра диафрагмы позволяют сузить толщину оптического слоя возле фокуса лазерного луча и избавляет от внефокусной флуоресценции.
При работе со стандартными микроскопами, которые используют в качестве источника возбуждения ртутную или ксеноновую лампу, при исследовании объекта, обладающего известной толщиной, изображение становится размытым и теряет контрастность. При работе же с лазерными источниками освещения происходит монохроматичность генерируемого света, он становится когерентным, что дает возможность расширить спектральный диапазон регистрируемой флуоресценции, улучшить подавление светорассеивания, уменьшается число бликов, улучшается точность фокусировки.
Использование лазерных сканирующих микроскопов в биологии
Конфокальные микроскопы изучают в реальном времени живые ткани, в которых можно проводить исследования ионов кальция с помощью флуоресцентных индикаторов, чувствительных к концентрации Ca. Ключевым фактором является возможность послойно визуализировать различные составные части организма: нервные волокна, сосуды, клетки иммунной системы и др.
Лазерная конфокальная микроскопия производит количественную оценку интернализиирующихся рецепторов и визуализирует их. Определить их внутриклеточную локализацию и проанализировать информацию об их перемещениях можно с помощью двухкомпонентной конфокальной иммуноцитохимии. При использовании данного метода изучения, белки маркируются напрямую флуофорами, что дает возможность визуализировать и изучить в реальном времени субклеточное расположение рецепторов, а также получить количественную оценку интернализации рецепторов.
При использовании лазерных конфокальных микроскопов можно изучать жизненные циклы органелл, которые находятся в клетке. Делается это с помощью специализированных меток. Флуофорными метками с мутацией гена, характерной для синдрома Вольфрама, на культуре нейронов показали, что из-за этой мутации изменилась динамика митохондрий (замедлялась их транспортировка по аксону, ингибировалось слияние митохондрий, нарушалась митофагия), что в свою очередь нарушило функцию нейронов.
Заключение
LSCM имеет ряд преимуществ перед флуоресцентной микроскопией, позволяя быстро и эффективно визуализировать живые организмы, динамические процессы и оптическое секционирование 3D-образцов в 2D-срезах. Многоканальные изображения могут быть сделаны на нескольких длинах волн, что приводит к повышению качества.
Основным недостатком SDCM является то, что только небольшая часть информации передается к объекту, но с настраиваемыми и вторичными дисками микрообъективов и высокочувствительными камерами эти ограничения легко преодолеть.