|
|
|
|
|
Конфокальный биологический инвертированный микроскоп Olympus FV3000 |
Конфокальный биологический прямой микроскоп Olympus FV3000 прямой |
Мультифотонный биологический инвертированный микроскоп Olympus FVMPE-RS |
Лазерный сканирующий конфокальный биологический микроскоп предназначен для получения максимально возможного, для световых микроскопов, разрешения благодаря применению лазера в качестве источника освещения и способу получения изображения. Своё название этот класс оборудования получил из-за особенности формирования изображения в фокальной плоскости. Кратко, механизм получения изображения описывается, как послойное формирование изображения образца на одном уровне глубины резкости, за счёт ограничения глубины фокуса и использования точечных когерентных источников света. Последняя особенность позволяет называть эти приборы «лазерный сканирующий микроскоп с точечной диафрагмой».
Конфокальная микроскопия предлагает несколько преимуществ по сравнению с обычной широкопольной оптической микроскопией, включая возможность контроля глубины резкости, устранения или уменьшения фоновой информации за пределами фокальной плоскости (фон приводит к ухудшению качества изображения), а также возможность сбора последовательных оптических срезов из толстых образцов. Основным ключом к конфокальному подходу является использование методов пространственной фильтрации для устранения расфокусированного света или бликов в образцах, толщина которых превышает непосредственную плоскость фокусировки. В последние годы возросла популярность конфокальной микроскопии, отчасти из-за относительной легкости получения чрезвычайно высококачественных изображений из образцов, подготовленных для обычной флуоресцентной микроскопии, и растущего числа применений в клеточной биологии. Это применимо для визуализации как фиксированных, так и живых клеток, тканей. Фактически, конфокальная технология оказывается одним из самых важных достижений, когда-либо достигнутых в оптической микроскопии.

В обычном широкопольном оптическом эпифлуоресцентном микроскопе Olympus BX63 вторичная флуоресценция, испускаемая образцом, часто происходит через возбужденный объем и скрывает разрешение элементов, лежащих в фокальной плоскости объектива. Проблема усугубляется более толстыми образцами (более 2 микрометров), которые обычно проявляют настолько высокую степень флуоресцентного излучения, что большая часть мелких деталей теряется. Конфокальная микроскопия обеспечивает лишь незначительное улучшение как осевого (z; вдоль оптической оси), так и бокового (x и y; в плоскости образца) оптического разрешения, но способна исключить вторичную флуоресценцию в областях, удаленных из фокальной плоскости, из результирующих изображений , Хотя разрешение с помощью конфокальной микроскопии несколько улучшается по сравнению с традиционными методами широкого поля, оно все же значительно меньше, чем у просвечивающего электронного микроскопа. В этом отношении конфокальная микроскопия может считаться мостом между этими двумя классическими методологиями.
На рисунке 1 представлены серии изображений, которые сравнивают выбранные поля зрения в традиционной широкоугольной и лазерной сканирующей конфокальной флуоресцентной микроскопии. Толстый участок флуоресцентно окрашенного мозгового вещества человека при широкополосной флуоресценции демонстрирует большое количество бликов от флуоресцентных структур выше и ниже фокальной плоскости (рис. 1 (а)). При получении изображения с помощью лазерного сканирующего конфокального микроскопа (рис. 1 (d)) толстый разрез продолговатого мозга показывает значительную степень структурных деталей. Аналогичным образом, широкополосная флуоресцентная визуализация целых мышечных волокон кролика, окрашенных флуоресцеином, дает размытые изображения (рис. 1 (б)), в которых отсутствуют детали, в то время как в том же поле образца (рис. 1 (д)) обнаружена сильно полосатая топография в конфокальной микроскопии. Автофлуоресценция в зерне пыльцы подсолнечника дает нечеткое очертание основной внешней морфологии (рис. 1 (с)), но не дает указаний на внутреннюю структуру. Напротив, тонкий оптический участок того же зерна (рис. 1 (f)), полученный с помощью конфокальных методов, демонстрирует существенную разницу между ядром частицы и окружающей оболочкой.
Исторический очерк
Основная концепция конфокальной микроскопии была первоначально разработана Марвином Мински в середине 1950-х годов (запатентовано в 1957 году), когда он учился в докторантуре Гарвардского университета. Минский хотел изобразить нейронные сети в неокрашенных препаратах мозговой ткани и руководствовался желанием изобразить биологические события, происходящие в живых системах. Изобретение Мински осталось в значительной степени незамеченным, скорее всего, из-за отсутствия источников интенсивного света, необходимых для получения изображений, и компьютерной мощности, необходимой для обработки больших объемов данных. После работы Минского М. Дэвид Эггер и Моймир Петран в конце 1960-х годов изготовили многолучевой конфокальный микроскоп, который использовал вращающийся (Nipkow) диск для исследования неокрашенных срезов мозга и ганглиозных клеток. Продолжая работать в этой области, Эггер продолжил разработку первого механически сканированного конфокального лазерного микроскопа и опубликовал первые узнаваемые изображения клеток в 1973 году. В конце 1970-х и 1980-х годах были достигнуты успехи в области компьютерных и лазерных технологий в сочетании с новыми алгоритмами для цифрового манипуляции с изображениями привели к растущему интересу к конфокальной микроскопии.
К счастью, вскоре после истечения срока действия патента Мински несколько исследователей превратили практические конструкции конфокального микроскопа с лазерным сканированием в рабочие инструменты. Голландский физик Г. Фред Бракенхофф разработал сканирующий конфокальный микроскоп в 1979 году, в то время как почти одновременно Колин Шеппард внес свой вклад в эту технику с помощью теории формирования изображений. Тони Уилсон, Брэд Амос и Джон Уайт разработали эту концепцию и позже (в конце 1980-х) продемонстрировали полезность конфокальной визуализации при исследовании флуоресцентных биологических образцов. Первые коммерческие приборы появились в 1987 году. В 1990-х годах достижения в области оптики и электроники позволили получить более стабильные и мощные лазеры, высокоэффективные сканирующие зеркальные блоки, высокопроизводительную волоконную оптику, улучшенные тонкопленочные диэлектрические покрытия и детекторы с пониженными шумовыми характеристиками. Кроме того, начали синтезироваться флуорохромы, которые были более тщательно подобраны к линиям лазерного возбуждения. В сочетании с быстро растущей скоростью компьютерной обработки, улучшенными дисплеями и технологией хранения больших объемов, появившейся в конце 1990-х годов, была подготовлена почва для виртуального взрыва числа приложений, на которые можно было ориентироваться с помощью лазерной сканирующей конфокальной микроскопии.
Современные конфокальные микроскопы можно рассматривать как полностью интегрированные электронные системы, в которых оптический микроскоп играет центральную роль в конфигурации, состоящей из одного или нескольких электронных детекторов, компьютера (для отображения, обработки, вывода и хранения изображений) и нескольких лазерных систем. в сочетании с устройствами выбора длины волны и блоком сканирования луча. В большинстве случаев интеграция между различными компонентами настолько тщательна, что весь конфокальный микроскоп часто все вместе называют цифровой или видеосистемой, способной создавать электронные изображения. Эти микроскопы в настоящее время используются для рутинных исследований молекул, клеток и живых тканей, которые были невозможны всего несколько лет назад.
Принцип работы конфокального микроскопа
Конфокальный принцип в эпифлуоресцентной лазерной сканирующей микроскопии схематически представлен на рисунке 2. Когерентный свет, излучаемый лазерной системой (источником возбуждения), проходит через апертуру-обскуру, расположенную в сопряженной плоскости (конфокальной) с точкой сканирования на образце. и второе отверстие-обскура, расположенное перед детектором (фотоумножитель). Когда лазер отражается от дихроматического зеркала и сканируется по образцу в определенной фокальной плоскости, вторичная флуоресценция, излучаемая точками на образце (в одной и той же фокальной плоскости), проходит обратно через дихроматическое зеркало и фокусируется в качестве софокусной точки на отверстие детектора
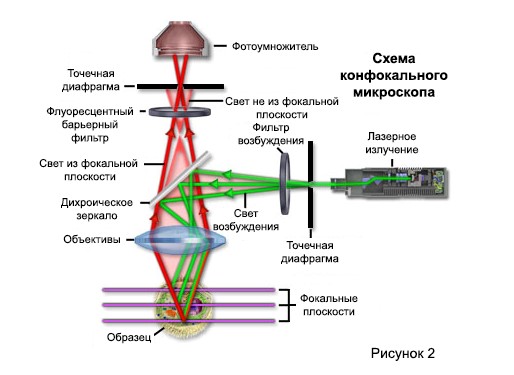
В традиционной широкопольной эпифлуоресцентной микроскопии весь образец подвергается интенсивному освещению от некогерентной ртутной или ксеноновой дуговой разрядной лампы, и полученное изображение вторичного флуоресцентного излучения можно просматривать непосредственно в окулярах или проецировать на поверхность электронного матричный детектор или традиционная пленочная плоскость. В отличие от этой простой концепции, механизм формирования изображения в конфокальном микроскопе принципиально иной. Как обсуждалось выше, конфокальный флуоресцентный микроскоп состоит из нескольких источников лазерного возбуждения, сканирующей головки с оптическими и электронными компонентами, электронных детекторов (обычно фотоумножителей) и компьютера для сбора, обработки, анализа и отображения изображений.
Сканирующая головка находится в центре конфокальной системы и отвечает за растеризацию сканирующих возбуждений, а также за сбор фотонных сигналов от образца, необходимых для сборки окончательного изображения. Типичная сканирующая головка содержит входные сигналы от внешних лазерных источников, наборов флуоресцентных фильтров и дихроматических зеркал, систему растровых сканирующих зеркал на основе гальванометра, переменные отверстия с точечными отверстиями для генерации конфокального изображения и детекторы с фотоумножителями, настроенные для различных длин волн флуоресценции. Общее расположение компонентов сканирующей головки представлено на рисунке 3 для типичного коммерческого блока.
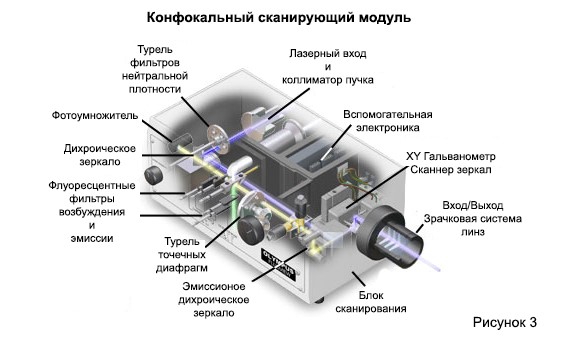
В сканирующей конфокальной микроскопии с эпи-освещением источник лазерного излучения и детекторы фотоумножителей отделены от образца объективом, который функционирует как хорошо скорректированный конденсатор и объективная комбинация. Внутренние компоненты фильтра флуоресценции (такие как фильтры возбуждения и барьера, а также дихроматические зеркала) и фильтры нейтральной плотности содержатся внутри блока сканирования (см. Рисунок 3). Фильтры помех и нейтральной плотности размещаются во вращающихся револьверных головках или ползунках, которые могут быть вставлены оператором в световой тракт. Лазерный луч возбуждения соединен с блоком сканирования с помощью оптоволоконного соединителя, за которым следует расширитель луча, который позволяет тонкому запястью лазерного луча полностью заполнить заднюю апертуру объектива (критическое требование в конфокальной микроскопии). Расширенный лазерный свет, который проходит через объектив микроскопа, образует интенсивное ограниченное дифракцией пятно, которое сканируется соединенными зеркалами гальванометра растровым рисунком по плоскости образца (точечное сканирование).
Одним из наиболее важных компонентов блока сканирования является апертура точечного отверстия, которая действует как пространственный фильтр на плоскости сопряженного изображения, расположенной непосредственно перед фотоумножителем. Несколько отверстий различного диаметра обычно находятся на вращающейся турели, что позволяет оператору регулировать размер отверстия (и толщину оптического сечения). Вторичная флуоресценция, собираемая объективом, отсекается теми же гальванометрическими зеркалами, которые образуют растровую структуру, а затем проходит через барьерный фильтр, прежде чем достигнуть апертуры отверстия. Апертура служит для исключения флуоресцентных сигналов от объектов, находящихся не в фокусе, расположенных выше и ниже фокальной плоскости, которые вместо этого проецируются на апертуру в виде дисков Эйри, диаметр которых намного больше, чем у формирующих изображение. Эти негабаритные диски распределены по сравнительно большой площади, так что через отверстие проходит лишь небольшая часть света, исходящего из плоскостей, удаленных от фокальной точки. Апертура отверстия также позволяет устранить большую часть рассеянного света, проходящего через оптическую систему. Соединение точечного сканирования с ограниченной апертурой к пространственному фильтру с точечным отверстием в плоскости сопряженного изображения является важной особенностью конфокального микроскопа.
При контрастировании сходств и различий между широкоугольными и конфокальными микроскопами часто бывает полезно сравнить характер и геометрию освещения образца, используемого для каждого из методов. Традиционные широкоугольные эпифлуоресцентные микроскопы фокусируют широкий конус освещения на большом объеме образца, который освещается равномерно и одновременно (как показано на рис. 4 (а)). Большая часть флуоресцентного излучения, направленного обратно в микроскоп, собирается объективом (в зависимости от числовой апертуры) и проецируется в окуляры или детектор. Результатом является значительное количество сигнала из-за испускаемого фонового света и автофлуоресценции, исходящих из областей выше и ниже фокальной плоскости, что серьезно снижает разрешение и контраст изображения.
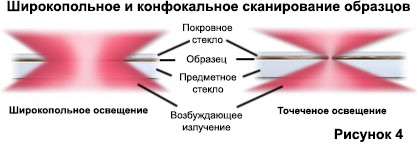
Лазерный источник освещения в конфокальной микроскопии сначала расширяется, чтобы заполнить заднюю апертуру объектива, а затем фокусируется системой линз на очень маленькое пятно в фокальной плоскости (рис. 4 (b)). Размер точки освещения колеблется от 0,25 до 0,8 микрометра в диаметре (в зависимости от объективной числовой апертуры) и глубины от 0,5 до 1,5 микрометра при самой яркой интенсивности. Размер конфокального пятна определяется конструкцией микроскопа, длиной волны падающего лазерного излучения, характеристиками объектива, настройками сканирующего устройства и образцом. На рисунке 4 представлено сравнение между типичными конусами освещения широкопольного (рис. 4 (а)) и точечного сканирующего конфокального (рис. 4 (б)) микроскопа при той же числовой апертуре. Вся глубина образца по широкой области освещается широкоугольным микроскопом, в то время как образец сканируется с помощью точно сфокусированного пятна освещения, центрированного в фокальной плоскости конфокального микроскопа.
В лазерной сканирующей конфокальной микроскопии изображение расширенного образца генерируется путем сканирования сфокусированного луча через определенную область в растровой схеме, управляемой двумя высокоскоростными колеблющимися зеркалами, приводимыми в движение гальванометрическими двигателями. Одно из зеркал перемещает луч слева направо вдоль поперечной оси x, а другое переводит луч в направлении y. После каждого отдельного сканирования вдоль оси x луч быстро транспортируется обратно в начальную точку и смещается вдоль оси y, чтобы начать новое сканирование в процессе, называемом обратным рейсом. Во время операции возврата информация об изображении не собирается. Таким образом, интересующая область на образце в одной фокальной плоскости возбуждается лазерным излучением от сканирующего блока.
Когда каждая линия сканирования проходит вдоль образца в боковой фокальной плоскости, флуоресцентное излучение собирается объективом и возвращается обратно через конфокальную оптическую систему. Скорость сканирования зеркал очень мала по отношению к скорости света, поэтому вторичное излучение следует по световому пути вдоль оптической оси, которая идентична исходному лучу возбуждения. Возврат флуоресцентного излучения через систему зеркал гальванометра называется дексканированием. Покидая сканирующие зеркала, флуоресцентное излучение проходит непосредственно через дихроматическое зеркало и фокусируется на отверстии точечного отверстия. В отличие от растровой схемы сканирования возбуждающего света, проходящего по образцу, флуоресцентное излучение остается в устойчивом положении в апертуре точечного отверстия, но колеблется в зависимости от интенсивности во времени, когда пятно освещения проходит образец, вызывая изменения в возбуждении.
Флуоресцентное излучение, которое проходит через апертуру-обскуры, с помощью фотоумножителя преобразуется в аналоговый электрический сигнал, имеющий постоянно изменяющееся напряжение (соответствующее интенсивности). Аналоговый сигнал периодически дискретизируется и преобразуется в пиксели с помощью аналого-цифрового (АЦП) преобразователя, размещенного в блоке сканирования или в прилагаемом электронном шкафу. Информация об изображении временно сохраняется в буфере кадров изображения в компьютере и отображается на мониторе. Важно отметить, что конфокальное изображение образца восстанавливают, точка за точкой, из эмиссии фотонных сигналов с помощью фотоумножителя и сопутствующей электроники, но никогда не существует в качестве реального изображения, которое можно наблюдать через окуляры микроскопа.
Конфигурация конфокального микроскопа Olympus FV3000 с лазерным сканированием
Основные характеристики оптической системы микроскопа в течение многих десятилетий оставались в основном неизменными из-за технических ограничений на объективный дизайн, статических свойств большинства образцов и того факта, что разрешение определяется длиной волны света. Однако флуоресцентные зонды, которые используются для добавления контраста к биологическим образцам и другим технологиям, связанным с методами оптической микроскопии, значительно улучшились. Взрывной рост и развитие конфокального подхода является прямым результатом возрождения в оптической микроскопии, чему в значительной степени способствовали достижения в современной оптической и электронной технике. Среди них - стабильные многоволновые лазерные системы, которые обеспечивают лучшее покрытие ультрафиолетовой, видимой и ближней инфракрасной областей спектра, улучшенные интерференционные фильтры (включая дихроматические зеркала, барьерные фильтры и фильтры возбуждения), чувствительные малошумящие широкополосные детекторы и гораздо более мощные компьютеры. Последние теперь доступны с относительно дешевыми массивами памяти, пакетами программного обеспечения для анализа изображений, видеодисплеями с высоким разрешением и высококачественными цифровыми принтерами изображений. Поток информации через современный конфокальный микроскоп схематически представлен на рисунке 5.
Хотя многие из этих технологий были разработаны независимо для различных целевых приложений, они постепенно были включены в основные коммерческие системы конфокальной микроскопии. В современных микроскопических системах классификация образцов основана на технологии, используемой для сканирования образцов. Сканирование может быть выполнено либо путем перемещения ступени в направлениях x, y и z, когда пятно лазерного освещения удерживается в фиксированном положении, либо сам луч может сканироваться растром по всему образцу. Поскольку трехмерная трансляция сцены громоздка и подвержена вибрации, большинство современных инструментов используют какой-либо механизм сканирования луча.
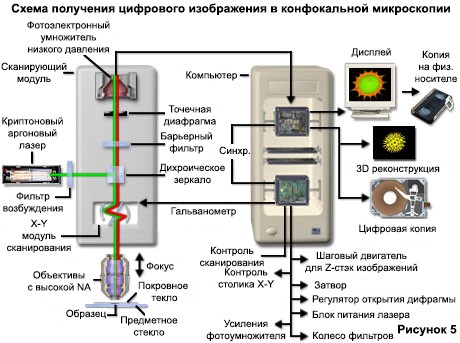
В современных конфокальных микроскопах были разработаны два принципиально различных метода сканирования луча. Однолучевое сканирование, один из наиболее популярных методов, используемых в большинстве коммерческих лазерных сканирующих микроскопов, использует пару управляемых компьютером зеркал гальванометра для сканирования образца в растровом режиме со скоростью примерно один кадр в секунду. Более высокая скорость сканирования (почти до скорости видео) может быть достигнута с помощью акустооптических устройств или колеблющихся зеркал. Напротив, многолучевые сканирующие конфокальные микроскопы оснащены вращающимся диском Нипкова, содержащим массив точечных отверстий и микролинз. Эти приборы часто используют дуговые разрядные лампы для освещения вместо лазеров, чтобы уменьшить повреждение образца и улучшить обнаружение низких уровней флуоресценции во время сбора изображений в реальном времени. Другой важной особенностью многолучевых микроскопов является их способность легко захватывать изображения с помощью матричного детектора, такого как система камер с зарядовой связью (CCD).
Все конструкции конфокальных микроскопов с лазерным сканированием сосредоточены вокруг обычного вертикального или инвертированного оптического микроскопа исследовательского уровня. Однако вместо стандартной вольфрам-галогенной или ртутной дуговой разрядной лампы одна или несколько лазерных систем используются в качестве источника света для возбуждения флуорофоров в образце. Информация об изображении собирается точка за точкой с помощью специализированного детектора, такого как фотоумножитель или лавинный фотодиод, а затем оцифровывается для обработки главным компьютером, который также управляет сканирующими зеркалами и / или другими устройствами для облегчения сбора и отображения изображений. После того, как серия изображений (обычно последовательные оптические срезы) была получена и сохранена на цифровом носителе, анализ может быть выполнен с использованием многочисленных пакетов программного обеспечения для обработки изображений, доступных на главном или вспомогательном компьютере.
Преимущества и недостатки конфокальной микроскопии
Основным преимуществом лазерной сканирующей конфокальной микроскопии является возможность серийного получения тонких (от 0,5 до 1,5 микрометра) оптических срезов через флуоресцентные образцы толщиной до 50 микрометров и более. Серия изображений собирается путем координации постепенных изменений в механизме точной фокусировки микроскопа (с использованием шагового двигателя) с последовательным получением изображения на каждом шаге. Информация об изображении ограничена четко определенной плоскостью, а не усложняется сигналами, исходящими из удаленных мест в образце. Контрастность и четкость значительно улучшены по сравнению с методами широкого поля благодаря уменьшению фоновой флуоресценции и улучшению отношения сигнал-шум. Кроме того, оптическое сечение устраняет артефакты, которые возникают во время физического среза и флуоресцентного окрашивания образцов ткани для традиционных форм микроскопии. Техника неинвазивного конфокального оптического сечения позволяет исследовать как живые, так и фиксированные образцы в различных условиях с повышенной четкостью.
В большинстве пакетов программного обеспечения для конфокальной микроскопии оптические сечения не ограничиваются перпендикулярной боковой (x-y) плоскостью, но также могут быть собраны и отображены в поперечных плоскостях. Вертикальные разрезы в плоскостях x-z и y-z (параллельные оптической оси микроскопа) могут быть легко созданы большинством конфокальных программ. Таким образом, образец выглядит так, как если бы он был разрезан в плоскости, перпендикулярной боковой оси. На практике вертикальные срезы получают путем объединения серии x-y-сканов, выполненных вдоль оси z, с программным обеспечением, а затем проецируют изображение интенсивности флуоресценции, которое могло бы появиться, если бы оборудование микроскопа могло физически выполнять вертикальное сечение.
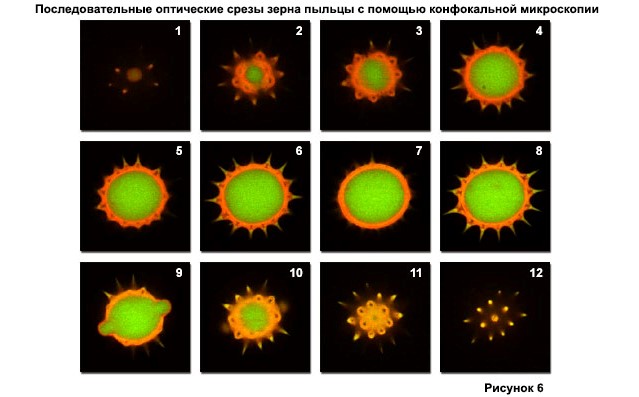
Типичный набор оптических срезов (часто называемых z-сериями) через пыльцевое зерно подсолнечника, выявляющий внутренние изменения в длинах волн автофлуоресцентного излучения, показан на рисунке 6. Оптические срезы были собраны с шагом 0,5 микрометра перпендикулярно оси z (микроскоп оптический). ось) с использованием двойной аргон-ионной (488нм; зеленая флуоресценция) и зеленой гелий / неоновой (543нм; красная флуоресценция) лазерной системы. Пыльцевые зерна этого вида имеют диаметр от 20 до 40 микрометров и дают размытые изображения при широкополосной флуоресцентной микроскопии (см. Рис. 1 (с)), в которых отсутствует информация о внутренних структурных деталях. Хотя на рисунке представлены только 12 из более 48 изображений, собранных в этой серии, они представляют отдельные фокальные плоскости, разделенные расстоянием приблизительно 3 микрометра, и обеспечивают хорошую индикацию внутренней структуры зерен.
В образцах, более сложных, чем пыльцевое зерно, сложные взаимосвязанные структурные элементы может быть трудно различить по большой серии оптических срезов, последовательно получаемых по объему образца с помощью лазерного сканирующего конфокального микроскопа. Однако после того, как будет собрана адекватная серия оптических срезов, она может быть далее обработана в трехмерном представлении образца с использованием вычислительных методов визуализации объема. Этот подход в настоящее время широко используется, чтобы помочь выяснить многочисленные взаимосвязи между структурой и функцией клеток и тканей в биологических исследованиях. Чтобы обеспечить сбор достаточных данных для получения репрезентативного объемного изображения, оптические срезы должны регистрироваться с соответствующими осевыми (с шагом по оси z) интервалами, чтобы фактическая глубина образца отражалась на изображении.
Большинство пакетов программного обеспечения, сопровождающих коммерческие конфокальные инструменты, способны генерировать составные и многомерные изображения данных оптического сечения, полученных из стеков изображений серии z. Трехмерные программные пакеты могут использоваться для создания либо единственного трехмерного представления образца (рис. 7), либо видеопоследовательности (фильма), скомпилированной из разных представлений об объеме образца. Эти последовательности часто имитируют эффект вращения или аналогичное пространственное преобразование, которое повышает оценку трехмерного характера образца. Кроме того, многие программные пакеты позволяют исследователям проводить измерения длины, объема и глубины, а конкретные параметры изображений, такие как непрозрачность, можно интерактивно изменять, чтобы выявить внутренние структуры, представляющие интерес, на разных уровнях в образце.
Типичные трехмерные изображения нескольких образцов, исследованных путем последовательного оптического сечения, представлены на фиг.7. Оптические срезы пыльцевых зерен, показанные на фиг.1 и 6, были объединены, чтобы получить реалистичный вид внешней поверхности (рис. 7 (а)), так как может появиться при осмотре на сканирующем электронном микроскопе. Алгоритм, используемый для построения трехмерной модели, позволяет пользователю поворачивать зерно пыльцы на 360 градусов для исследования. Клетки культуры ткани на фиг.7 (b) получены из линии яичника китайского хомячка (CHO) и были трансфицированы химерным плазмидным вектором, содержащим зеленый флуоресцентный белок и белок вируса иммунодефицита человека (ВИЧ), который экспрессируется в ядре (таким образом, маркировка ядерного региона). Толстые срезы ткани также легко просматривать в трех измерениях, построенных из оптических срезов. Срез кишечника мыши, показанный на фиг. 7 (с), был помечен несколькими флуорофорами и создан из набора из 45 оптических срезов.

Во многих случаях составной или проекционный вид, созданный из серии оптических сечений, предоставляет важную информацию о трехмерном образце, чем многомерный вид. Например, флуоресцентно меченный нейрон, имеющий многочисленные тонкие протяженные отростки в срезе ткани, трудно (если не невозможно) изобразить с использованием широкополосных методов из-за размытости в фокусе. Каждый из конфокальных тонких срезов одного и того же нейрона выявляет участки нескольких расширений, но они обычно выглядят как фрагментированные полосы и точки и не имеют непрерывности. Составные изображения, созданные путем сглаживания ряда оптических срезов от нейрона, покажут все протяженные процессы в четком фокусе с четко определенной непрерывностью. Структурный и функциональный анализ других клеточных и тканевых срезов также выигрывает от составных изображений в отличие от трехмерных методов объемного рендеринга или в сочетании с ними.
Достижения в области конфокальной микроскопии позволили получить многомерные изображения живых клеток и тканей, которые включают информацию об изображении в измерениях x, y и z как функцию времени и представлены в нескольких цветах (с использованием двух или более флуорофоров). После обработки объема отдельных стеков изображений полученные данные могут отображаться в виде трехмерных многоцветных видеопоследовательностей в режиме реального времени. Обратите внимание, что в отличие от обычной широкопольной микроскопии, все флуорохромы в образцах с множественной маркировкой появляются в регистре с использованием конфокального микроскопа. Временные данные могут быть собраны либо из покадровых экспериментов, проводимых в течение длительных периодов, либо путем получения изображений в реальном времени в небольших кадрах в течение коротких периодов времени. Потенциал использования многомерной конфокальной микроскопии в качестве мощного инструмента в клеточной биологии продолжает расти, так как разрабатываются новые лазерные системы для ограничения повреждения клеток и повышения скорости компьютерной обработки и емкости памяти.
Дополнительные преимущества сканирующей конфокальной микроскопии включают возможность электронной регулировки увеличения путем изменения области, сканируемой лазером, без необходимости менять объективы. Эта функция называется коэффициентом масштабирования и обычно используется для регулировки пространственного разрешения изображения путем изменения периода выборки сканирующего лазера. Увеличение коэффициента масштабирования уменьшает сканируемую область образца и одновременно снижает скорость сканирования. В результате увеличивается число выборок по сопоставимой длине, что увеличивает как пространственное разрешение изображения, так и увеличение изображения на мониторе главного компьютера. Конфокальный зум обычно используется для согласования цифрового разрешения изображения с оптическим разрешением микроскопа, когда для сбора данных используются объективы с низкой числовой апертурой и увеличением.
Оцифровка последовательных данных аналоговых изображений, собранных с помощью фотоумножителя конфокального микроскопа (или подобного детектора), облегчает алгоритмы компьютерной обработки изображений путем преобразования непрерывного потока напряжения в дискретные цифровые приращения, которые соответствуют изменениям интенсивности света. В дополнение к преимуществам и скорости обработки цифровых данных можно легко подготовить изображения для печати или публикации. В тщательно контролируемых экспериментах количественные измерения интенсивности пространственной флуоресценции (статически или как функция времени) также могут быть получены из цифровых данных.
Недостатки конфокальной микроскопии ограничиваются, прежде всего, ограниченным количеством длин волн возбуждения, доступных в обычных лазерах (называемых лазерными линиями), которые возникают в очень узких полосах и являются дорогостоящими в ультрафиолетовой области. Напротив, в обычных широкопольных микроскопах используются дуговые газоразрядные лампы на основе ртути или ксенона для обеспечения полного диапазона длин волн возбуждения в ультрафиолетовой, видимой и ближней инфракрасной областях спектра. Другим недостатком является вредная природа высокоинтенсивного лазерного облучения живых клеток и тканей (проблема, которая недавно была решена с помощью многофотонной и конфокальной визуализации диска Нипкова). Наконец, высокая стоимость покупки и эксплуатации многопользовательских систем конфокальных микроскопов, которые могут быть на порядок выше, чем у сопоставимых широкопольных микроскопов, часто ограничивает их применение в небольших лабораториях. Эта проблема может быть легко решена с помощью микроскопических систем с разделением затрат, которые обслуживают один или несколько отделов в основном учреждении. Недавнее внедрение персональных конфокальных систем привело к снижению цен на низкоуровневые конфокальные микроскопы и увеличило число индивидуальных пользователей.